根据《医疗器械注册与备案管理办法》的规定,已注册的第二类医疗器械产品,发生的除设计、原材料、生产工艺、适用范围、使用方法等实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续以外其他变化的,应当在变化之日起30日内向原注册部门备案。
注册人名称和住所、代理人名称和住所等,属于前款规定的需要备案的事项。境内医疗器械生产地址变更的,注册人应当在办理相应的生产许可变更后办理备案。
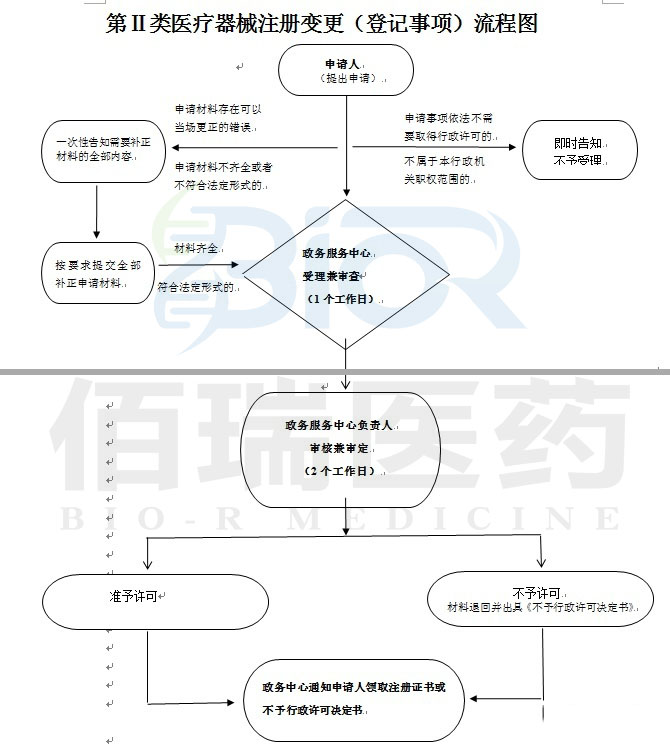
注册登记事项变更不收取变更注册申请费用
文件名称 | 文号 |
《医疗器械监督管理条例》 | 国务院令第739号 |
《医疗器械注册与备案管理办法》 | 国家市场监督管理总局令第47号 |
《医疗器械说明书和标签管理规定》 | 国家食品药品监督管理总局令第6号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第28号 |
《医疗器械生产监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械经营监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械分类规则》 | 国家食品药品监督管理总局令第15号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第28号 |
预算、合同、考虑期,1个月。
考虑检测平均消耗6个月,视产品情况有所变化,如无强标更新,则可免除检测。
如需精算请联络佰瑞医药。(免临床目录产品除外。)
注册资料编制可与检测并行。
NMPA法定消耗预算8个月。(158工日,20工日/月,不计节假,与首次注册一致。)
发补时限0~12个月,考虑平均时间6个月。视产品首次申报资料情况而定。
NMPA II、III类医疗器械注册咨询;
NMPA 体外诊断试剂注册咨询;
NMPA 进口I、II、III类医疗器械注册咨询;
NMPA I类医疗器械备案办理咨询;
医疗器械优先审批办理咨询
创新医疗器械审批申请服务
体系建立\内审\运行\考核服务;
医疗器械临床试验服务;
注册、体系、临床培训服务;